Кетогенная диета при рефрактерных психических заболеваниях
The Ketogenic Diet for Refractory Mental Illness: A Retrospective Analysis of 31 Inpatients
ретроспективный анализ с участием 31 стационарного пациента
Предыстория и гипотеза. Надежная доказательная база, подтверждающая терапевтическую пользу кетогенных диет при эпилепсии и других неврологических состояниях, предполагает, что такой же метаболический подход может также принести пользу при психических заболеваниях.
Дизайн исследования: в этом ретроспективном анализе клинической помощи 31 взрослый пациент с тяжелым, стойким психическим заболеванием (такие как большое депрессивное расстройство, биполярное расстройство и шизоаффективное расстройство), чьи симптомы плохо контролировались, несмотря на интенсивное психиатрическое лечение, были госпитализированы в психиатрическую больницу и помещены в психиатрическую больницу. Они были на кетогенной диете, которая ограничена максимум 20 граммами углеводов в день, в качестве дополнения к обычному стационарному лечению. Продолжительность вмешательства колебалась от 6 до 248 дней.
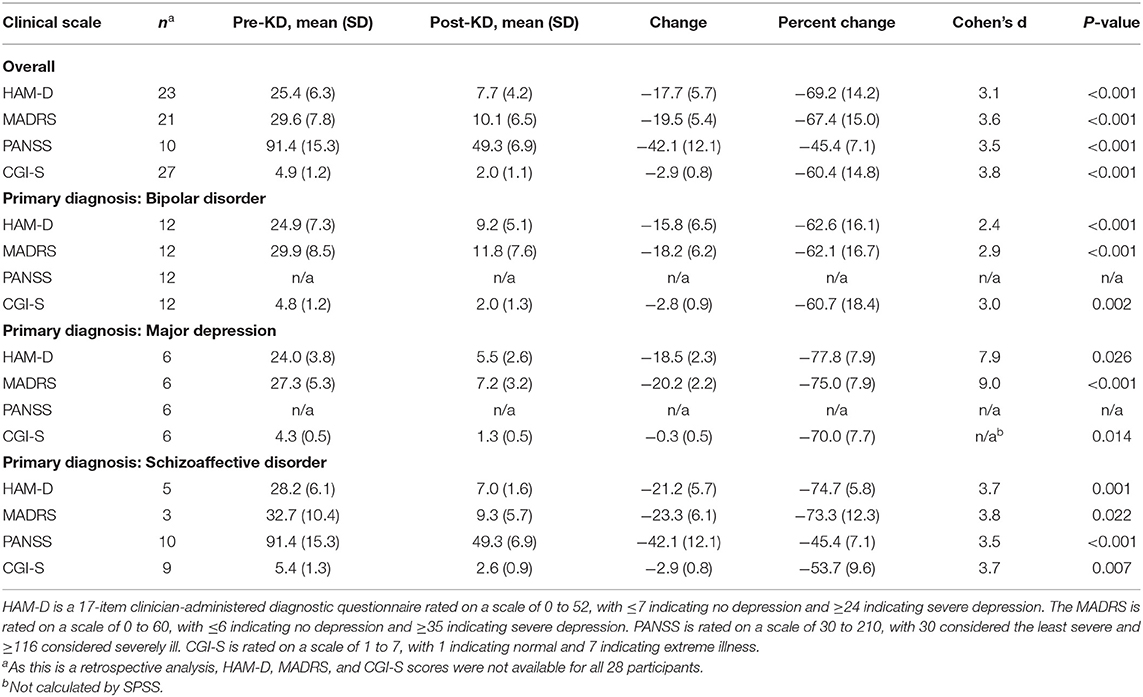
Результаты исследования: трое пациентов не могли соблюдать диету более 14 дней и были исключены из окончательного анализа. Среди включенных участников средние значения и стандартные отклонения (СО) улучшились по баллам по шкале оценки депрессии Гамильтона с 25,4 (6,3) до 7,7 (4,2), P <0,001 и по шкале оценки депрессии Монтгомери-Асберга с 29,6 (7,8) до 10,1 (6,5). ), р < 0,001. Среди 10 пациентов с шизоаффективным заболеванием средние (SD) баллы по Шкале позитивного и негативного синдрома (PANSS) улучшились с 91,4 (15,3) до 49,3 (6,9), P <0,001. Значительные улучшения также наблюдались в показателях метаболического здоровья, включая вес, кровяное давление, уровень глюкозы в крови и триглицериды.
Выводы. Применение кетогенной диеты в этих полуконтролируемых условиях у пациентов с рефрактерным к лечению психическим заболеванием было возможным, хорошо переносимым и сопровождалось значительным и существенным улучшением симптомов депрессии и психоза, а также улучшением множественных маркеров метаболического здоровья.
Введение
Предпосылки
Доктор Данан (Dr. Danan), первый в списке автор исследования, был практикующим психиатром в Тулузе, Франция, в течение 35 лет. Население, которое проживает в области обслуживания его госпиталя, состоит в основном из людей французского и североафриканского происхождения с серьезными, стойкими психическими заболеваниями, многие из которых также страдают метаболическими заболеваниями, такими как ожирение, гипертония и диабет 2 типа. Несмотря на интенсивное амбулаторное психофармакологическое и психотерапевтическое лечение, большинству этих лиц требуется частая госпитализация и они не могут работать из-за психической инвалидности. Увидев заметное улучшение рефрактерных к лекарствам судорог и поведения при аутизме у члена семьи в течение нескольких недель после принятия КД, д-р Данан заинтересовался потенциалом КД для улучшения психического и метаболического статуса его наиболее резистентных к лечению пациентов, вне зависимости от диагноза. Он создал программу лечения метаболической психиатрии в Clinique du Castelviel, психиатрической больнице общего профиля на 129 коек в Кастельмаре, Франция, где пациенты с хроническими психическими заболеваниями, исчерпавшие стандартную психиатрическую терапию, могли попробовать КД в благоприятной среде под медицинским наблюдением.
Материалы и методы
Это ретроспективный анализ изменения состояния госпитализированных взрослых с серьезными и стойкими психическими заболеваниями, которым давали КД вместо стандартного больничного меню. В период с мая 2019 г. по апрель 2020 г. 31 взрослый человек, чьи хронические психические симптомы плохо контролировались, несмотря на интенсивное психофармакологическое лечение, был госпитализирован в Clinique du Castelviel и помещен на КД под наблюдением лечащего психиатра доктора Данана. Эта программа лечения была одобрена администрацией Clinique du Castelviel и этическим комитетом.
Участники
Участниками были беcплатные добровольцы, отобранные доктором Дананом из его амбулаторной психиатрической практики. В каждом случае было получено информированное согласие. Критериями приемлемости были неспособность адекватно реагировать на обычную психиатрическую помощь и готовность попробовать КД. Критериями исключения были нервная анорексия, ИМТ ниже 18,5 кг/м2, беременность, кормление грудью и противопоказания (23). Первичными психиатрическими диагнозами были биполярное расстройство второго типа (n = 13), шизоаффективное расстройство (n = 12) и большое депрессивное расстройство (n = 7). У всех участников был хотя бы один показатель плохого метаболического здоровья, такой как избыточный вес, ожирение, гипертония и/или повышенный уровень глюкозы в крови натощак. Большинство участников находились под наблюдением доктора Данана в течение многих лет (в среднем [SD] 10 [7] лет, диапазон от 5 месяцев до 30 лет), и все они в прошлом были госпитализированы в психиатрическую больницу под его наблюдением один или несколько раз либо в это время, либо в том же учреждении или в аналогичном аффилированном учреждении с минимальным клиническим улучшением. Никто из участников никогда раньше не пытался следовать низкоуглеводной диете.
Из 31 пациента 22 были госпитализированы с целью инициации КД в контролируемых условиях. Остальные 9 были первоначально госпитализированы для обычного лечения, но позже согласились на КД, поскольку не диетические вмешательства оказались неэффективными. Все участники исследования — 31 пациент, принимали психотропные препараты на момент начала КД.
В дополнение к протоколу KD, который был краеугольным камнем их плана лечения, участники также получали обычную помощь, доступную для всех пациентов, поступивших в это отделение. Персонал больницы состоял из 8 психиатров, 3 психологов, 2 врачей общей практики, 2 социальных работников, эрготерапевта, инструктора по лечебной физкультуре и диетолога. Заболевания, которые обычно лечили в этом учреждении, включали расстройства настроения, шизофрению, расстройства, связанные с употреблением психоактивных веществ, и расстройства пищевого поведения. Участники проживали в стационаре 6 дней в неделю, но могли свободно покидать больницу по выходным на срок до 36 часов подряд.
Статистический анализ
Средние значения и стандартные отклонения были рассчитаны для непрерывных переменных; частотные распределения рассчитывались для номинальных и порядковых переменных. Мы использовали парные t-тесты, когда предварительные различия имели нормальное распределение, и критерий знакового ранга Уилкоксона, когда различия были искажены, используя SPSS 28.0.1.1.
Метод Воздействия
Используемый протокол KD был адаптирован из протокола, использованного доктором Вестманом (Dr. Westman) в клинических испытаниях в Duke University (24); см. Дополнительный рисунок 1 : Протокол кетогенной диеты для получения подробной информации и примерного плана питания. Вкратце, потребление углеводов было ограничено до 20 граммов в день (приблизительно 5% дневных калорий), исключительно из овощей, орехов, лимонного сока и небольшого количества темного шоколада. Белок составляет 15–20% дневной нормы калорий и поступает из мяса, морепродуктов, птицы, молочных продуктов, яиц и орехов. Жиры составляли 75–80% рациона; разрешенными добавленными жирами были оливковое масло, кокосовое масло, сливочное масло, майонез и сметана.
Участникам было предоставлено 3 приема пищи в соответствии с протоколом в день (приготовленные диетологом больницы для обеспечения достаточного количества белка и калорий), 1 коробка с закусками в соответствии с протоколом в день (составленная доктором Dr. Danan, купленная участниками и выдаваемая ежедневно доктором Дананом). Danan) и список разрешенных продуктов, которых следует придерживаться всегда. Участники также получали один раз в день добавки рыбьего жира (250 мг: 18% EPA, 12% DHA), оксид магния (300 мг), медь (1 мг), витамин B1 (1,1 мг), витамин B5 (6 мг), витамин B6 (3,4 мг), витамин B12 (2,5 мг) и витамин C (330 мг).
Доктор Данан встречался индивидуально с каждым участником 6 дней в неделю, чтобы следить за клиническим прогрессом и обеспечивать обучение диете и поддержку. Приверженность диете оценивалась с использованием информации, полученной в результате этих частых бесед с врачами, ежедневных дневников питания участников и наблюдений медсестры. Приверженность была охарактеризована как отличная у тех, кто успешно ограничил потребление углеводов до максимум 20 граммов в день не менее 6 дней в неделю, хорошая у тех, кто достиг этой цели не менее 5 дней в неделю, и удовлетворительная у тех, кто достиг этой цели в минимум 4 дня в неделю. Ацетоацетат мочи измеряли не менее одного раза у каждого участника в течение периода вмешательства. Метаболический мониторинг, включая анализы крови, кровяное давление и массу тела, проводился в день 0 КД и снова в последний день КД, непосредственно перед выпиской из больницы.
Дата госпитализации, продолжительность госпитализации, продолжительность БК и недиеологические аспекты лечения варьировались в зависимости от клинических обстоятельств. Лекарства были скорректированы на основе клинического суждения.
Основные показатели результатов
Основными показателями результата исследования, определяемыми до вмешательства, были изменение симптомов депрессии по шкале оценки депрессии Гамильтона (HAM-D) (25) и шкале оценки депрессии Монтгомери-Асберга (MADRS)(26), а также изменение симптомов психоза по шкале оценки депрессии. измеряется по Шкале позитивного и негативного синдрома (PANSS) (27, 28).
Вторичные исходы, представляющие интерес, включали медицинскую и психиатрическую безопасность, влияние на метаболические биомаркеры, изменение потребности в лекарствах и изменение тяжести заболевания, оцениваемые с использованием шкалы общих клинических впечатлений (CGI-S) (29, 30).
Полученные результаты
Характеристики пациентов
Трое из 31 пациента (10%) не могли наблюдать за КД более 14 дней и были исключены из окончательного анализа из-за отсутствия данных о влиянии диеты; поэтому эта серия случаев состоит из 28 госпитализированных взрослых [средний (SD) возраст, 50 (11,3) лет, диапазон 27–73 лет; 71% женщин]. Средняя (SD) продолжительность госпитализации составила 85,4 (76,8) дня (диапазон 16–270 дней), а средняя (SD) продолжительность KD составила 59,1 (49,6) дня (диапазон 15–248 дней).
Соблюдение диеты
Что касается 3 исключенных пациентов, упомянутых выше: 1 прекратил KD, сославшись на отвращение к пищевым жирам, 1 сослался на отсутствие семейной и финансовой поддержки и 1 сослался на финансовые трудности, отвращение к пищевым жирам и неприязнь к ограничениям плана.
Среди включенных 28 пациентов, которые придерживались диеты более 2 недель, измерения кетонов в моче были произведены один раз во время вмешательства, и были положительными у 18 из 28 пациентов (64%). Приверженность диете была охарактеризована как отличная у 11 пациентов (39%), хорошая у 12 пациентов (43%) и удовлетворительная у 5 пациентов (18%).
Изменения показателей психического здоровья, описанные ниже, представлены в Tаблице 1. Заметное улучшение настроения и психотических симптомов наблюдались у всех 28 пациентов (100%) во время вмешательства, обычно в течение 3 недель или менее после начала КД.
Симптомы шизофрении
После вмешательства KD у всех 10 (100%) пациентов с первичным диагнозом шизоаффективного расстройства наблюдалось улучшение показателей PANSS, при этом средний (SD) показатель PANSS снизился с 91,4 (15,3) до 49,3 (6,9), P < 0,001, шкала Коэна. д = 3,5. Снижение на 16,5 и более баллов по шкале PANSS считается минимальной клинически значимой разницей (31) и было достигнуто у 10/10 (100%) пациентов.
Симптомы депрессии
HAM-D был назначен 23 из 28 пациентов, включая всех 18 с первичным диагнозом непсихотического заболевания. После вмешательства КД у всех 23 (100%) пациентов наблюдалось улучшение показателей по шкале HAM-D, при этом средний (СО) показатель по шкале HAM-D снизился с 25,4 (6,3) до 7,7 (4,2), P <0,001, d Коэна = 3,1. . MADRS был проведен 21 из 28 пациентов, включая всех 18 с первичным диагнозом непсихотического заболевания. После вмешательства KD все 21 (100%) продемонстрировали улучшение показателей MADRS, при этом средний (SD) показатель MADRS снизился с 29,6 (7,8) до 10,1 (6,5), P <0,001, d Коэна = 3,6.
Снижение на 4 балла и более по шкале HAM-D считается минимальной клинически значимой разницей и было достигнуто у всех 22 пациентов, у которых оценивались баллы по шкале HAM-D, независимо от диагноза. Снижение на 7 и более баллов, которое считается существенно клинически важным, было достигнуто у 21/22 пациентов (95%) (32).
Снижение не менее чем на 6 баллов по шкале MADRS считается минимальной клинически значимой разницей и было достигнуто у всех 21 пациента (100%), у которых оценивались баллы по шкале MADRS, независимо от диагноза.
CGI-S
Тяжесть заболевания была оценена у 27 из 28 пациентов с помощью CGI-S. После вмешательства KD средний (SD) CGI-S улучшился с 4,9 (1,2) до 2,0 (1,1), d Коэна = 3,8. Поскольку это изменение нарушало предположение о нормальности, мы провели ранговый критерий Уилкоксона, который показал, что изменение было статистически значимым, Z = -4,65, P <0,001 (см. Рисунок 1), у 12 из 28 пациентов (43%). достижения клинической ремиссии. Снижение на 1 балл по шкале CGI-S считается минимальной клинически значимой разницей (33). У всех пациентов достигнуто снижение не менее чем на 2 балла по шкале CGI-S независимо от диагноза (Коэн d = 3,8).
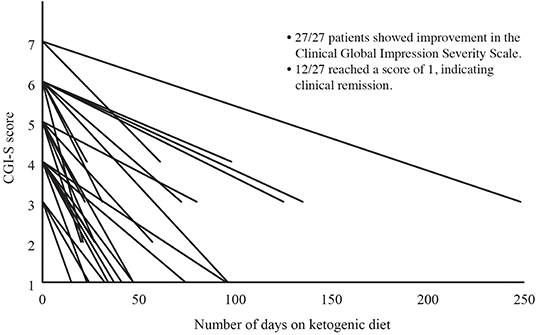 Рисунок 1. Изменение общей шкалы тяжести клинических впечатлений (CGI-S) с течением времени. Тяжесть заболевания была оценена у 27 из 28 пациентов с помощью CGI-S. CGI-S оценивается по шкале от 1 до 7, где 1 указывает на нормальное состояние, а 7 указывает на крайнее заболевание. После вмешательства KD показатели CGI-S улучшились у всех 27 пациентов, при этом 12 из 27 (44%) достигли CGI-S, равного 1 (клиническая ремиссия).
Рисунок 1. Изменение общей шкалы тяжести клинических впечатлений (CGI-S) с течением времени. Тяжесть заболевания была оценена у 27 из 28 пациентов с помощью CGI-S. CGI-S оценивается по шкале от 1 до 7, где 1 указывает на нормальное состояние, а 7 указывает на крайнее заболевание. После вмешательства KD показатели CGI-S улучшились у всех 27 пациентов, при этом 12 из 27 (44%) достигли CGI-S, равного 1 (клиническая ремиссия).
Изменения в приеме лекарствах
До вмешательства среднее (SD) количество психотропных препаратов, принимаемых на одного пациента, составляло 5,3 (2,0), при этом 25 из 28 (89%) пациентов принимали по крайней мере один антипсихотический препарат. К концу вмешательства количество и/или дозировка психотропных препаратов были снижены у 18 из 28 (64%) пациентов (см. Рисунок 2). Среди 7 пациентов, которые также принимали непсихотропные препараты, количество и/или дозировка этих препаратов были снижены у 5 из 7 пациентов (71%). Соматические препараты были уменьшены и/или прекращены: инсулин, метформин, аторвастатин, гликлазид и тикагрелор.
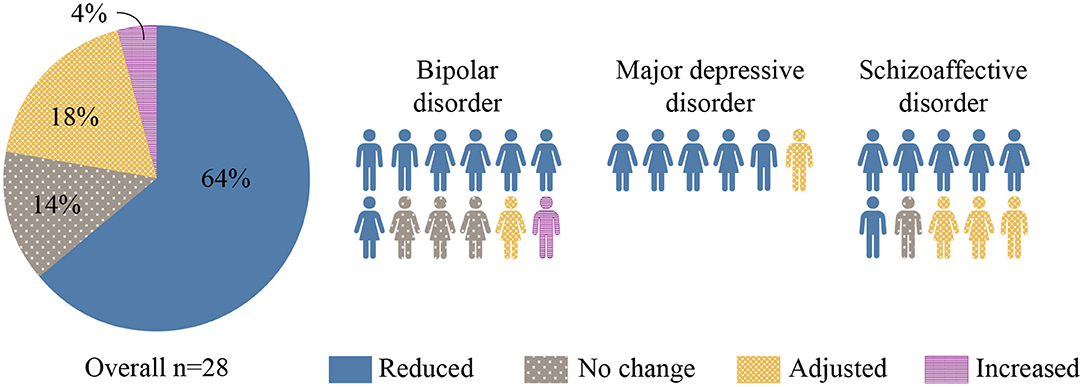 Рисунок 2. Изменения в психотропных препаратах. На этом рисунке представлены изменения в количестве и/или дозировке психотропных препаратов, связанные с вмешательством КД. Большинство (64%) участников были выписаны с меньшим количеством лекарств.
Рисунок 2. Изменения в психотропных препаратах. На этом рисунке представлены изменения в количестве и/или дозировке психотропных препаратов, связанные с вмешательством КД. Большинство (64%) участников были выписаны с меньшим количеством лекарств.
Метаболические показатели здоровья
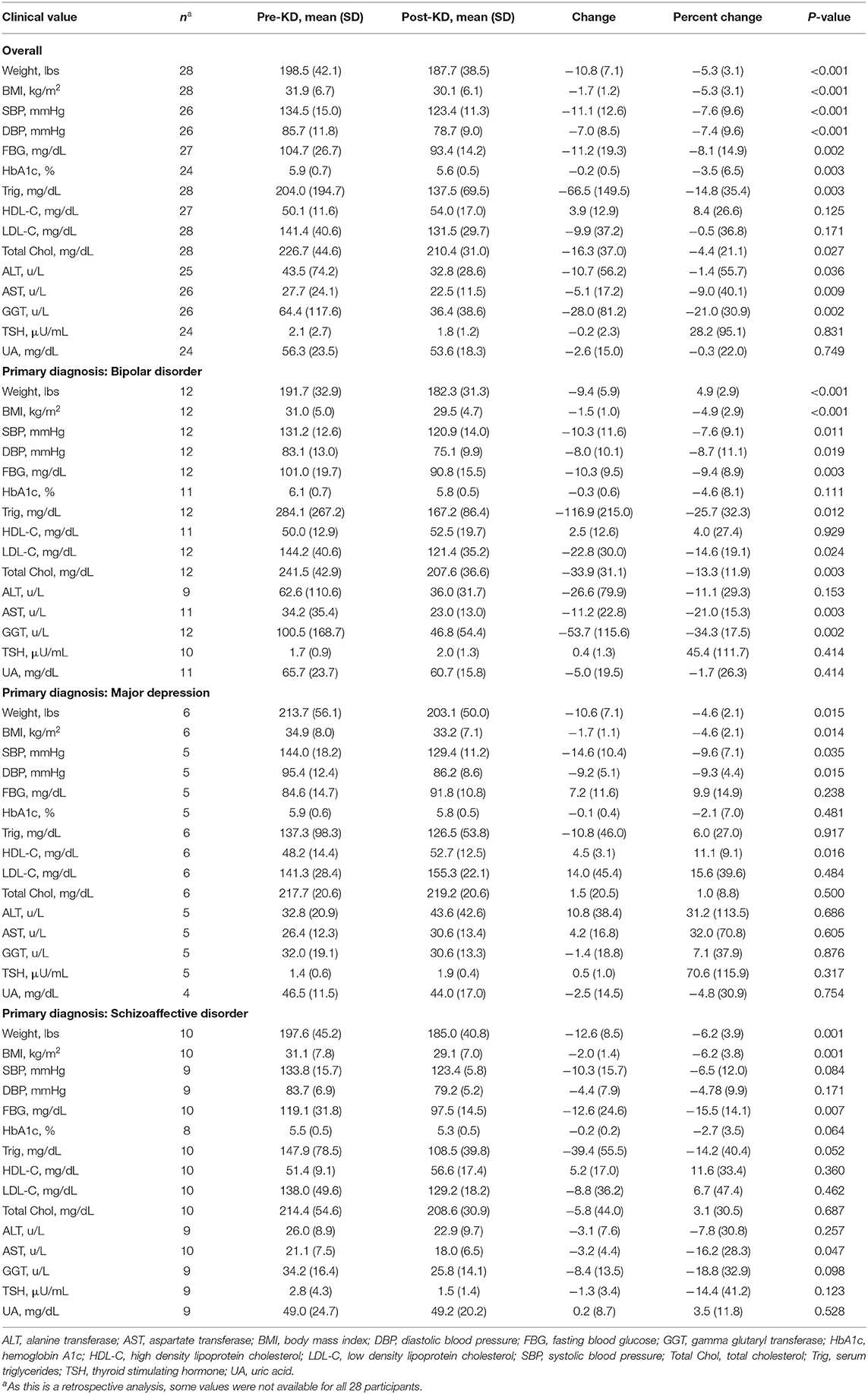
Показатели метаболического здоровья подробно описаны в Tаблице 2. До вмешательства средняя (SD) масса тела составляла 198,5 (42,1) фунтов (диапазон 145,7–310,9 фунтов), а средний (SD) ИМТ составлял 31,9 (6,7) кг/м2 (диапазон 23,0). –51,2 кг/м2). Исходный ИМТ находился в пределах нормы (18,5–24,9 кг/м2) у 3/28 (10,7%) пациентов, в диапазоне избыточной массы тела (25,0–29,9 кг/м2) у 7/28 (25,0%) пациентов и в диапазон ожирения (≥30,0 кг/м2) у 18/28 (64,3%) пациентов. По завершении вмешательства все пациенты, кроме одного (27 из 28; 96,4%), потеряли вес. Следует отметить, что 24 из 25 (96%) пациентов, принимавших нейролептики, потеряли вес, а 12 из этих 25 (48%) достигли клинически значимого снижения веса [определяемого как снижение массы тела на ≥5% (34)]. Общее изменение веса [среднее значение (SD), -10,8 (-7,1) фунтов]; и изменение ИМТ [среднее (SD), -1,7 (1,2) кг/м2] были значительными (P <0,001), как и снижение уровня глюкозы в крови натощак, гемоглобина A1c, систолического и диастолического артериального давления и гамма-глутамилтрансферазы (ГГТ). Также наблюдалось значительное общее снижение уровня аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), общего холестерина и триглицеридов (ТГ). Среди 14 из 28 (50%) пациентов, которые изначально соответствовали критериям гипертриглицеридемии (ТГ > 150 мг/дл), заметное снижение уровня триглицеридов на 100 мг/дл и более наблюдалось у 7 (50%), у 5 пациентов (36%). больше не соответствует критериям гипертриглицеридемии после вмешательства. Уровни С-реактивного белка также были измерены, но из-за нескольких случаев инфекции значения были сочтены ненадежными.
Переносимость кетогенной диеты
Most patients initially experienced one or more symptoms commonly reported during early keto-adaptation (35), such as headache, insomnia, irritability, excitation, dizziness, and carbohydrate cravings. These were mild, required no special medical or psychiatric management, and resolved within 2 weeks or less. Beyond this initial transition period, the KD was psychiatrically well tolerated by all patients, and 27 of 31 (87%) experienced no problematic somatic side effects. Two (excluded) patients cited fat intolerance, and 2 (included) patients experienced diarrhea and/or vomiting which resolved within 4 weeks. A fifth patient developed gastroenteritis during week 5 of the intervention and discontinued the diet, but later resumed the KD without ill effects, suggesting gastroenteritis was unlikely to have been KD related.
Большинство пациентов изначально испытывали один или несколько симптомов, обычно сообщаемых во время ранней кето-адаптации (35), таких как головная боль, бессонница, раздражительность, возбуждение, головокружение и тяга к углеводам. Они были легкими, не требовали специального медицинского или психиатрического лечения и разрешились в течение 2 недель или раньше. После этого начального переходного периода КД хорошо переносился всеми пациентами с психиатрической точки зрения, а у 27 из 31 (87%) не было проблемных соматических побочных эффектов. Два (исключенных) пациента указали на непереносимость жиров, а у 2 (включенных) пациентов наблюдались диарея и/или рвота, которые прошли в течение 4 недель. У пятого пациента развился гастроэнтерит в течение 5-й недели вмешательства, и он прекратил диету, но позже возобновил КД без каких-либо побочных эффектов, предполагая, что гастроэнтерит вряд ли был связан с КД.
Соблюдение диеты после госпитализации
В течение нескольких месяцев после выписки из больницы 13 из 28 включенных пациентов (46%) сообщили о хорошем соблюдении КД в домашних условиях, 5 (18%) сообщили о частичном соблюдении диеты, 6 (21%) прекратили диету, 1 прекратил диету, а затем возобновил ее, и 3 были потеряны для последующего наблюдения. Те, кто решил продолжить КД после выписки, сделали это, чтобы сохранить или улучшить психиатрические и метаболические преимущества, полученные во время госпитализации. Причины прекращения включали стоимость питания, трудности с приготовлением пищи, ограниченность, и низкую мотивацию.
Обсуждение
Эта попытка использования КД была безопасной, практичной- ее можно было вводить в стационарных условиях, она хорошо переносилась большинством пациентов и сопровождалась существенным и статистически значимым улучшением симптомов депрессии и психоза, не наблюдавшихся во время предыдущих госпитализаций. Величина эффекта была значительной (Cohen’s d > 0,8) (36) по всем показателям исхода психического здоровья во всех подгруппах и была очень значительной среди пациентов с первичным диагнозом большой депрессии. Учитывая, что вмешательства, осуществленные во время этой госпитализации, отличались только добавлением КД к обычному уходу, мы считаем вероятным, что КД в значительной степени способствовала этим беспрецедентным улучшениям психического здоровья, особенно у 79% пациентов, которым были либо снижены дозы психотропных препаратов. или же остались без изменений. Заметные улучшения нескольких маркеров метаболического здоровья, включая массу тела, артериальное давление, уровень глюкозы в крови и триглицериды, наблюдаемые в этой серии, было бы трудно приписать какому-либо аспекту госпитализации, кроме КД, которая, как известно, способствует этим здоровым изменениям (37).
Исторический и научный контекст
Недавнее нерандомизированное исследование 262 амбулаторных пациентов с диабетом 2 типа, получавших КД, выявило значительное улучшение настроения. В эту когорту вошли 36 пациентов с легкой клинической депрессией, более половины из которых больше не соответствовали критериям депрессии на 10-й неделе (38).
Насколько нам известно, эта серия случаев представляет собой первое исследование использования КД у госпитализированных пациентов с биполярным расстройством или тяжелым депрессивным расстройством и только второе исследование использования КД у госпитализированных пациентов с психотическим заболеванием, которое было впервые опубликовано в 1965 г. (39). В этом пилотном исследовании КД вводили 10 женщинам с рефрактерной к лечению шизофренией, что привело к статистически значимому улучшению средних показателей симптомов через 2 недели. С того времени был задокументирован ряд отдельных сообщений о случаях, описывающих людей с психическими заболеваниями, которые значительно улучшились от КД; первое из них было опубликовано одним из нас в 2009 г. (40) и представляет собой пример длительного разрешения психотических симптомов и возможности полного прекращения приема антипсихотических препаратов.
Биологическая вероятность
Биологическая вероятность того, что КД может иметь терапевтическую пользу при большой депрессии, биполярном расстройстве и шизофрении, полностью подтверждается научной литературой (18, 41–44).
Большая депрессия
Inflammation is implicated in all three conditions but has been most extensively studied in depression. Inflammation plays a role in the development and course of many cases of clinical depression and is associated with poor response to antidepressant medications (45, 46). The KD has been shown to reduce inflammation via complex influences on both central and peripheral immunoregulatory pathways (47–50). The KD also influences multiple neurotransmitter systems involved in depression, including the dopaminergic, serotonergic, glutamatergic, and GABAergic systems (51).
Большая депрессия
Воспаление связано со всеми тремя состояниями, но наиболее подробно оно изучено при депрессии. Воспаление играет роль в развитии и течении многих случаев клинической депрессии и связано с плохой реакцией на антидепрессанты (45, 46). Было показано, что KD уменьшает воспаление за счет комплексного влияния как на центральные, так и на периферические иммунорегуляторные пути (47–50). KD также влияет на несколько систем нейротрансмиттеров, участвующих в депрессии, включая дофаминергическую, серотонинергическую, глутаматергическую и ГАМКергическую системы (51).
Биполярное расстройство
Among those with bipolar illness, there is a higher prevalence of impaired glucose metabolism even in drug-naïve individuals (52). Calkin (53) found that those with insulin resistance or type 2 diabetes are more likely to experience rapid mood cycling, less likely to respond to lithium, and more likely to suffer a more progressive disease course. Proposed mechanisms by which glucose and insulin dysregulation may dysregulate mood include damaging oxidative stress which, in turn, could impair mitochondrial function (16). Napolitano et al. (54) recently discovered that the KD can increase brain levels of glutathione, a ubiquitous intracellular antioxidant key to buffering oxidative stress. Campbell and Campbell (55) hypothesize that the KD might help ameliorate symptoms of bipolar illness by shifting the brain’s primary fuel source from glucose to ketone bodies, thereby bypassing existing mitochondrial defects and reducing further mitochondrial injury. Calkin et al. (56) have proposed that insulin resistance, via inflammatory damage to endothelial cells, can compromise the integrity of the blood-brain barrier (BBB) in people with bipolar illness. Interestingly, disruption of the tight junctions critical to BBB structure and function has been observed not only in bipolar illness but also in major depression and schizophrenia (57).
Среди лиц с биполярным расстройством нарушения метаболизма глюкозы более распространены даже у лиц, ранее не принимавших лекарственные препараты (52). Calkin (53) обнаружил, что люди с резистентностью к инсулину или диабетом 2 типа с большей вероятностью будут испытывать быструю смену настроения, с меньшей вероятностью реагируют на литий и с большей вероятностью будут страдать от более прогрессирующего течения заболевания. Предполагаемые механизмы, посредством которых дисрегуляция глюкозы и инсулина может нарушать регуляцию настроения, включают повреждающий окислительный стресс, который, в свою очередь, может нарушать функцию митохондрий (16). Наполитано и др. (54) недавно обнаружили, что КД может повышать уровень глутатиона в мозге, вездесущего внутриклеточного антиоксиданта, ключевого для буферизации окислительного стресса. Кэмпбелл и Кэмпбелл (55) предполагают, что КД может помочь облегчить симптомы биполярного расстройства за счет переключения основного источника топлива для мозга с глюкозы на кетоновые тела, тем самым устраняя существующие митохондриальные дефекты и уменьшая дальнейшее митохондриальное повреждение. Калкин и др. (56) предположили, что резистентность к инсулину из-за воспалительного повреждения эндотелиальных клеток может нарушить целостность гематоэнцефалического барьера (ГЭБ) у людей с биполярным расстройством. Интересно, что нарушение плотных контактов, важных для структуры и функции ГЭБ, наблюдалось не только при биполярном расстройстве, но также при большой депрессии и шизофрении (57).
Шизофрения
Гиперинсулинемия, резистентность к инсулину и нарушение метаболизма глюкозы чаще встречаются у лиц, ранее не получавших лечения, с первым эпизодом психоза, чем в общей популяции (58). Хотя одной этой ассоциации недостаточно для подтверждения причинно-следственной связи между нарушением регуляции метаболизма и психотическими симптомами, сообщалось о нескольких случаях острой гипергликемии, связанной с транзиторными психотическими симптомами, у пациентов с диабетом 1 и 2 типа (59). Патофизиологические особенности шизофрении, показанные в доклинических исследованиях Sarnyai et al. (44) для улучшения в ответ на KD включают гипофункцию рецептора N-метил-D-аспартата (NMDA), дефицит сенсорных ворот и эксайтотоксичность глутамата.
KD также помогают сбалансировать системы нейротрансмиттеров (16), стабилизировать нейронные сети (60), улучшить нейропластичность (61) и преодолеть энергетический разрыв, возникающий в результате гипометаболизма глюкозы в мозге, связанного с большой депрессией, биполярным расстройством и шизофренией (17).
Hyperinsulinemia, insulin resistance, and impaired glucose metabolism are more common in treatment-naïve individuals experiencing first-episode psychosis than in the general population (58). While this association alone is insufficient to support a causal relationship between metabolic dysregulation and psychotic symptoms, several cases of acute hyperglycemia associated with transient psychotic symptoms in patients with type 1 and type 2 diabetes have been reported (59). Pathophysiological features of schizophrenia shown in pre-clinical studies by Sarnyai et al. (44) to improve in response to a KD include N-methyl-D-aspartate (NMDA) receptor hypofunction, sensory gating deficits, and glutamate excitotoxicity.
KDs also help rebalance neurotransmitter systems, (16) stabilize neural networks (60), improve neuroplasticity (61), and bridge the energy gap resulting from the cerebral glucose hypometabolism associated with major depression, bipolar illness, and schizophrenia (17).
Strengths and Limitations
Сильные стороны и ограничения
Уникальные сильные стороны этой серии включают разнообразие психиатрических диагнозов и относительно большое количество пациентов, подвергшихся одному и тому же вмешательству в одних и тех же полуконтролируемых клинических условиях. Имея в виду эти элементы, мы решили не сообщать об этих результатах пациентов как об отдельных тематических исследованиях. Предоставление образования, наблюдения и поддержки со стороны психиатра, у которого были доверительные терапевтические союзы со своими пациентами до вмешательства, по-видимому, способствовало открытости пациентов к вмешательству и, вероятно, улучшило соблюдение диеты и честность в отношении нарушений, хотя этот особый контекст лечения делает неясно, возможны ли такие же результаты при других обстоятельствах.
Ни лечащий психиатр, ответственный за оценку результатов, ни сами пациенты не были осведомлены о вмешательстве, поэтому существует риск того, что впечатления от клинического прогресса могут быть предвзятыми. В то время как пациенты, возможно, выиграли от простой госпитализации, сила этой когорты заключается в том, что все пациенты ранее были госпитализированы под наблюдением доктора Данана по крайней мере один раз (а во многих случаях несколько раз) либо в это же учреждение, либо в родственное учреждение. где все не диетические аспекты помощи были очень похожи, однако доктор Данан сообщает, что никогда раньше не наблюдал такой степени клинического улучшения у этих пациентов. Таким образом, этих пациентов можно было бы рассматривать как отдельную группу для исторического сравнения, хотя исходы психического здоровья формально не измерялись во время предыдущих госпитализаций.
Как и при любом вмешательстве, при котором диета ad libitum заменяется интересующей структурированной диетой, манипулировали несколькими диетическими переменными, поэтому, даже если бы было возможно приписать клиническую пользу KD, все равно было бы трудно определить, какой аспект ( s) KD может нести ответственность за эти льготы. Например, эта версия KD была не только с низким содержанием углеводов, но и без зерна, с очень низким содержанием обработанных пищевых продуктов и дополнена микроэлементами. Поскольку прием пищи и закусок KD контролировался по порциям, пациенты также могли потреблять меньше калорий, чем обычно.
Unique strengths of this series include the diversity of psychiatric diagnoses and the relatively large number of patients exposed to the same intervention in the same semi-controlled clinical setting. It was with these elements in mind that we chose not to report these patient outcomes as individual case studies. The provision of education, monitoring, and support by a psychiatrist who had trusting therapeutic alliances with his patients prior to the intervention seemed to contribute to patients’ openness to the intervention and likely improved dietary adherence and honesty about transgressions, although this special treatment context makes it unclear whether these same outcomes would be possible under different circumstances.
Neither the treating psychiatrist responsible for assessing outcomes nor the patients themselves were blinded to the intervention, therefore there is a risk that impressions of clinical progress may have been biased. While patients may have benefited simply from having been hospitalized, a strength of this cohort is that all patients had previously been hospitalized under Dr. Danan’s care at least once (and in many cases, multiple times) at either this same facility or a sister facility where all non-dietary aspects of care were very similar, yet Dr. Danan reports never having observed this degree of clinical improvement in these patients before. These patients therefore might be considered to have served as their own historical comparison group, although mental health outcomes were not formally measured during previous hospitalizations.
As with any intervention in which ad libitum dietary patterns are replaced with a structured dietary pattern of interest, multiple dietary variables were manipulated, therefore even if it were possible to assign clinical benefits to the KD, it would still be difficult to determine which aspect(s) of the KD may be responsible for those benefits. For example, this iteration of the KD was not only low in carbohydrate—it was also grain-free, very low in processed foods, and supplemented with micronutrients. As KD meals and snacks were portion-controlled, patients may also have consumed fewer calories than usual.
Следует также отметить, что эта установка не позволяла полностью контролировать диетическое вмешательство, поскольку участникам разрешалось покидать отделение по выходным и, находясь в отделении, они могли взаимодействовать с неучаствующими пациентами, которым давали стандартную плату за проезд. Поскольку это не было отделение для исследований метаболизма, мониторинг кетонов в моче (который может быть полезен при оценке соблюдения диеты) был обременительным для занятого персонала и поэтому проводился только один раз для каждого пациента. Тем не менее, потеря веса является еще одним свидетельством того, что пациенты придерживались диетической программы, поскольку большинство людей с избыточным весом или ожирением теряют вес на КД (24), а клинически значимая потеря веса у людей с серьезными психическими заболеваниями в противном случае является неожиданной, даже когда осуществляются вмешательства в образ жизни, направленные на снижение веса (62). Все пациенты, кроме одного, потеряли вес, включая 96% из тех, кто принимал нейролептики, и почти половина из них достигла клинически значимого снижения веса [определяемого как снижение массы тела на ≥5% (34)]. Один только этот желанный результат делает убедительным доводом в пользу применения КД у людей, принимающих антипсихотические препараты, независимо от того, улучшаются ли психические симптомы в ответ на КД, поскольку противодействовать увеличению веса, вызванному антипсихотическими препаратами, чрезвычайно сложно (63).
Вопрос о том, может ли одна лишь потеря веса привести к уменьшению симптомов депрессии, биполярного расстройства (64) и/или психоза, остается в значительной степени без ответа. У людей с диабетом 2 типа, получавших КД, улучшение симптомов депрессии не коррелировало с потерей веса (38). Хотя исследования показывают, что люди с клинической депрессией, перенесшие бариатрическую операцию, сообщают о меньшем количестве симптомов депрессии через 6 месяцев или более после операции, изменение веса, по-видимому, является ненадежным предиктором улучшения настроения (65). Нам неизвестны какие-либо исследования, оценивающие влияние только потери веса на симптомы биполярных или психотических заболеваний.
It should also be noted that this setting did not allow for complete control over the dietary intervention, as participants were permitted to leave the unit on weekends, and while on the unit, could interact with nonparticipant patients who were served standard fare. As this was not a metabolic research ward, urine ketone monitoring (which can be helpful in assessing dietary adherence) was burdensome for busy staff, and therefore was conducted only once per patient. However, weight loss is another piece of evidence that patients were adherent to the dietary program, as most overweight or obese individuals will lose weight on a KD (24), and clinically meaningful weight loss in people with serious mental illness is otherwise unexpected, even when lifestyle interventions aimed at weight loss are implemented (62). All but one patient lost weight including 96% of those who were taking antipsychotics, and nearly half achieved clinically significant weight loss [defined as ≥5% reduction in body weight (34)]. This welcome outcome alone makes a compelling case for the implementation of the KD in people who are taking antipsychotic medications, whether or not psychiatric symptoms improve in response to the KD, as counteracting antipsychotic-induced weight gain is extremely difficult (63).
Whether weight loss alone could lead to a reduction in symptoms of depression, bipolar disorder (64), and/or psychosis remains a largely unanswered question. In people with type 2 diabetes treated with a KD, improvement in depression symptoms was not correlated with weight loss (38). While studies find that people with clinical depression who have undergone bariatric surgery report fewer depression symptoms 6 months or more following the procedure, weight change appears to be an unreliable predictor of improvements in mood (65). We are unaware of any studies evaluating the impact of weight loss alone on symptoms of bipolar or psychotic illnesses.
Practical Considerations
Практические соображения
Протоколы кетогенной диеты существуют в диапазоне от «классического» КД, первоначально использовавшегося для лечения лекарственно-резистентной педиатрической эпилепсии (90 % жира, 6 % белка, 4 % углеводов), до модифицированных КД, допускающих более высокий процент белка, до модифицированных диет Аткинса. диеты (66), при которых белок можно есть до насыщения (67). Протокол, который доктор Данан решил адаптировать для своих пациентов, относится к этой последней категории, хотя потребление белка в этих условиях было ограничено до 15-20% суточной калорийности, по крайней мере, 6 дней в неделю. Одним из преимуществ этого более либерального подхода является то, что не требуется точный контроль соотношения макронутриентов, что упрощает логистику как введения, так и соблюдения режима лечения.
В дополнение к редким метаболическим нарушениям, обычно диагностируемым в детстве, существует несколько состояний здоровья, которые многие считают абсолютными противопоказаниями для начала КД у взрослых; к ним относятся острый панкреатит, нефролитиаз, почечная недостаточность, печеночная недостаточность, застойная сердечная недостаточность, нервная анорексия и одновременное применение ингибиторов SGLT2.
Хорошо подобранный КД может быстро и эффективно снизить уровень глюкозы в крови, инсулина и артериального давления — все это считается клинически желательными целями у многих пациентов, особенно у пациентов с метаболическим синдромом. Тем не менее, эти в целом полезные физиологические адаптации к КД требуют тщательного медикаментозного лечения. Лекарства, снижающие уровень глюкозы в крови (такие как инсулин, производные сульфонилмочевины и меглитиниды), и лекарства, снижающие кровяное давление (такие как диуретики и ингибиторы АПФ), требуют тщательного мониторинга, так как некоторые из них, возможно, потребуется уменьшить или даже отменить уже в 1-й день от начала КД. для сведения к минимуму риска гипогликемических, гипотензивных и гиповолемических явлений (68, 69).
Нам неизвестны опубликованные исследования потенциальных взаимодействий между кетогенными диетами и психотропными препаратами, за заметным исключением противосудорожных препаратов. Исследования пациентов с эпилепсией, получавших КД, показали, что уровни антиконвульсантов могут меняться в зависимости от диеты. Хотя эти изменения обычно невелики и клинически несущественны, уровни вальпроата могут значительно снижаться (70). Поскольку эти агенты еще официально не изучались у людей с психическими заболеваниями, было бы разумно контролировать уровни в крови всех противосудорожных препаратов, а также любых других психиатрических препаратов, для которых изменения уровня в крови могут иметь клиническое значение, например литий. Принимая во внимание эти предостережения, для большинства взрослых пациентов потенциальные преимущества простых, хорошо составленных КД перевешивают потенциальные риски (71).
Ketogenic diet protocols exist on a spectrum ranging from the “classic” KD originally used to treat medication-refractory pediatric epilepsy (90% fat, 6% protein, 4% carbohydrate) to modified KDs which allow for higher percentages of protein, to modified Atkins diets (66), in which protein may be eaten to satiety (67). The protocol Dr. Danan chose to adapt for use with his patients falls into this last category, although protein intake was limited in this setting to 15–20% of daily calories at least 6 days per week. One advantage of this more liberal approach is that precision control of macronutrient ratios is not required, easing the logistics of both administration and adherence.
In addition to rare metabolic disorders typically diagnosed in childhood, there are several health conditions considered by many to be absolute contraindications to initiating KDs in adults; these include acute pancreatitis, nephrolithiasis, renal failure, liver failure, congestive heart failure, anorexia nervosa, and concurrent use of SGLT2 inhibitors.
A well-formulated KD can quickly and effectively lower levels of blood glucose, insulin, and blood pressure—all considered clinically desirable goals in many patients, particularly those with metabolic syndrome. However, these generally beneficial physiological adaptations to the KD necessitate careful medication management. Medications that lower blood glucose (such as insulin, sulfonylureas, and meglitinides) and medications that lower blood pressure (such as diuretics and ACE inhibitors) warrant diligent monitoring as some may need to be reduced or even discontinued as early as day 1 of KD initiation to minimize the risk of hypoglycemic, hypotensive, and hypovolemic events (68, 69).
We are unaware of published research on the potential interactions between ketogenic diets and psychotropic medications with the notable exception of anticonvulsants. Studies of patients with epilepsy treated with a KD find that anticonvulsant levels can change in response to the diet. Although these changes are typically small and clinically inconsequential, valproate levels can fall significantly (70). Since these agents have not yet been formally studied in people with psychiatric conditions, it would be prudent to monitor blood levels of all anticonvulsants as well as of any other psychiatric medications for which changes in blood level may be of clinical importance, such as lithium. With these cautions noted, for most adult patients, the potential benefits of simple, well-formulated KDs would seem to outweigh the potential risks (71).
Поскольку клинический ответ на БК в этой группе пациентов обычно наступал в течение 3 недель или менее, следует отметить, что сильно варьирующая и, в некоторых случаях, длительная продолжительность госпитализации в этой когорте была связана не с БК, а в основном с социально-экономическими факторами. . Во Франции стационарная психиатрическая помощь бесплатна для пациентов, койко-места высоки, а критерии госпитализации либеральны, поэтому многомесячное пребывание в стационаре является обычным явлением. Учитывая, что эта итерация КД в целом хорошо переносилась и была психиатрически безопасна даже в сложных случаях, входящих в эту серию, госпитализация может не потребоваться, если обеспечивается надлежащее медицинское наблюдение, особенно в отношении приема лекарств.
Ключом к успешному переходу на КД в любой популяции является диетическое просвещение и поддержка, и, вероятно, особенно важным в этой популяции было предоставление готовых блюд и закусок, поскольку в противном случае депрессия, психоз и другие серьезные психические симптомы могли усложнить логистику принятие и соблюдение КД (или любой новой диеты) грозно. Вполне возможно, что продуманно разработанная интенсивная амбулаторная программа могла бы обеспечить необходимую структуру и поддержку для пациентов с серьезными психическими заболеваниями при переходе на КД, и отрадно видеть, что почти половине пациентов в этой группе удалось продолжить лечение КД после увольнять.
As clinical response to the KD in this patient cohort typically occurred within 3 weeks or less, it should be noted that the highly variable and, in some cases, lengthy duration of hospitalization in this cohort was not related to the KD but largely to socioeconomic factors. In France, inpatient psychiatric care is cost-free for patients, bed availability is high, and hospitalization criteria are liberal, therefore stays lasting many months are commonplace. Given that this iteration of the KD was generally well tolerated and psychiatrically safe even in the complex cases that comprise this series, hospitalization may not be necessary so long as proper medical supervision is provided, particularly around medication management.
Key to the successful transition to a KD in any population is dietary education and support, and likely particularly important in this population was the provision of prepared meals and snacks, as depression, psychosis, and other serious psychiatric symptoms may otherwise have made the logistics of adopting and adhering to the KD (or any new diet) formidable. It is conceivable that a thoughtfully designed intensive outpatient program could provide the necessary structure and support for patients with serious mental illness to transition to a KD, and it is encouraging to see that nearly half of patients in this group managed to continue following a KD after discharge.
Future Research Considerations
Our observations warrant further research into the potential of the KD to improve the lives of people with mental illness. Many unanswered questions remain in this nascent field that carefully designed, adequately powered, randomized controlled trials—whether conducted in inpatient, outpatient, or virtual settings—could begin to address. As serum beta-hydroxybutyrate measurements are currently the most reliable method of assessing metabolic response to the KD, daily monitoring of this metric would help clinicians and patients understand whether the degree and consistency of ketosis are important to clinical outcomes.
Conclusion
In this retrospective analysis of clinical care, which to our knowledge represents the largest number of people with serious mental illness treated with a KD in a hospital setting thus far, we found that the KD was feasible, safe, well-tolerated, and associated with considerable improvements in mental health symptoms as well as in multiple markers of metabolic health. While more rigorous research is needed to confirm the association between the KD and improved mental health outcomes, these findings indicate that medically supervised carbohydrate restriction is a simple, safe, universally accessible intervention well worth considering as an adjunctive strategy in the treatment of serious mood and psychotic illnesses.
Data Availability Statement
The raw data supporting the conclusions of this article will be made available by the authors, without undue reservation.
Ethics Statement
This treatment program was approved by the Clinique du Castelviel (Castelmarou, France) Administration and Ethics Review. The patients/participants provided their written informed consent to participate in this study.
Author Contributions
AD conceived of and implemented the intervention and generated clinical data and observations. GE conducted the literature review and wrote the manuscript. EW and LS performed statistical analyses. All authors contributed to the article and approved the final manuscript.
Conflict of Interest
EW received consulting fees from Hill United Health and founded Adapt Your Life, Inc. (equity interest)—both companies founded on low-carbohydrate-diet principles—and received royalties for books that recommend a carbohydrate-restricted diet. GE reports stock options in DietDoctor.com, a company founded on low-carbohydrate principles.
The remaining authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Publisher’s Note
All claims expressed in this article are solely those of the authors and do not necessarily represent those of their affiliated organizations, or those of the publisher, the editors and the reviewers. Any product that may be evaluated in this article, or claim that may be made by its manufacturer, is not guaranteed or endorsed by the publisher.
Acknowledgments
We thank AD patients for their willingness to participate in this program and Suzanne Smith for her assistance with manuscript organization, formatting, and editing, as well as for translation support, data management, and figure creation.
Supplementary Material
The Supplementary Material for this article can be found online at: https://www.frontiersin.org/articles/10.3389/fpsyt.2022.951376/full#supplementary-material
References
1. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. (2018) 392:1789-858. doi: 10.1016/S0140-6736(18)32279-7
2. World Health Organization. Depression. (2021). Available online at: https://www.who.int/news-room/fact-sheets/detail/depression (accessed September 20, 2021).
3. Perlis RH, Ostacher MJ, Patel JK, Marangell LB, Zhang H, Wisniewski SR, et al. Predictors of recurrence in bipolar disorder: primary outcomes from the Systematic Treatment Enhancement Program for Bipolar Disorder (STEP-BD). Am J Psychiatry. (2006) 163:217–24. doi: 10.1176/appi.ajp.163.2.217
4. Jaffe DH, Rive B, Denee TR. The humanistic and economic burden of treatment-resistant depression in Europe: a cross-sectional study. BMC Psychiatry. (2019) 19:247. doi: 10.1186/s12888-019-2222-4
5. Leucht S, Leucht C, Huhn M, Chaimani A, Mavridis D, Helfer B, et al. Sixty years of placebo-controlled antipsychotic drug trials in acute schizophrenia: systematic review, Bayesian meta-analysis, and meta-regression of efficacy predictors. Am J Psychiatry. (2017) 174:927–42. doi: 10.1176/appi.ajp.2017.16121358
6. Leboyer M, Godin O, Llorca PM, Aubin V, Bellivier F, Belzeaux R, et al. Key findings on bipolar disorders from the longitudinal FondaMental Advanced Center of Expertise-Bipolar Disorder (FACE-BD) cohort. J Affect Disord. (2022) 307:149–56. doi: 10.1016/j.jad.2022.03.053
7. Pillinger T, McCutcheon RA, Vano L, Mizuno Y, Arumuham A, Hindley G, et al. Comparative effects of 18 antipsychotics on metabolic function in patients with schizophrenia, predictors of metabolic dysregulation, and association with psychopathology: a systematic review and network meta-analysis. Lancet Psychiatry. (2020) 7:64–77. doi: 10.1016/S2215-0366(19)30416-X
8. Strassnig M, Kotov R, Cornaccio D, Fochtmann L, Harvey PD, Bromet EJ. Twenty-year progression of body mass index in a county-wide cohort of people with schizophrenia and bipolar disorder identified at their first episode of psychosis. Bipolar Disord. (2017) 19:336–43. doi: 10.1111/bdi.12505
9. Marcus SC, Zummo J, Pettit AR, Stoddard J, Doshi JA. Antipsychotic adherence and rehospitalization in schizophrenia patients receiving oral versus long-acting injectable antipsychotics following hospital discharge. J Manag Care Spec Pharm. (2015) 21:754–68. doi: 10.18553/jmcp.2015.21.9.754
10. Jensen NJ, Wodschow HZ, Nilsson M, Rungby J. Effects of ketone bodies on brain metabolism and function in neurodegenerative diseases. Int J Mol Sci. (2020) 21:8767. doi: 10.3390/ijms21228767
11. Höhn S, Dozières-Puyravel B, Auvin S. History of dietary treatment from Wilder’s hypothesis to the first open studies in the 1920s. Epilepsy Behav. (2019) 101:106588. doi: 10.1016/j.yebeh.2019.106588
12. deCampo DM, Kossoff EH. Ketogenic dietary therapies for epilepsy and beyond. Curr Opin Clin Nutr Metab Care. (2019) 22:264–8. doi: 10.1097/MCO.0000000000000565
13. Grigolon RB, Gerchman F, Schöffel AC, Hawken ER, Gill H, Vazquez GH, et al. Mental, emotional, and behavioral effects of ketogenic diet for non-epileptic neuropsychiatric conditions. Prog Neuropsychopharmacol Biol Psychiatry. (2020) 102:109947. doi: 10.1016/j.pnpbp.2020.109947
14. El-Mallakh RS, Paskitti ME. The ketogenic diet may have mood-stabilizing properties. Med Hypotheses. (2001) 57:724–6. doi: 10.1054/mehy.2001.1446
15. Baker MG, Kale R, Menken M. The wall between neurology and psychiatry. BMJ. (2002) 324:1468–9. doi: 10.1136/bmj.324.7352.1468
16. Brietzke E, Mansur RB, Subramaniapillai M, Balanzá-Martínez V, Vinberg M, González-Pinto A, et al. Ketogenic diet as a metabolic therapy for mood disorders: evidence and developments. Neurosci Biobehav Rev. (2018) 94:11–6. doi: 10.1016/j.neubiorev.2018.07.020
17. Clay HB, Sillivan S, Konradi C. Mitochondrial dysfunction and pathology in bipolar disorder and schizophrenia. Int J Dev Neurosci. (2011) 29:311–24. doi: 10.1016/j.ijdevneu.2010.08.007
18. Norwitz NG, Dalai SS, Palmer CM. Ketogenic diet as a metabolic treatment for mental illness. Curr Opin Endocrinol Diabetes Obes. (2020) 27:269–74. doi: 10.1097/MED.0000000000000564
19. Cox N, Gibas S, Salisbury M, Gomer J, Gibas, K. Ketogenic diets potentially reverse Type II diabetes and ameliorate clinical depression: a case study. Diabetes Metab Syndr. (2019) 13:1475–9. doi: 10.1016/j.dsx.2019.01.055
20. Phelps JR, Siemers SV, El-Mallakh RS. The ketogenic diet for type II bipolar disorder. Neurocase. (2013) 19:423–6. doi: 10.1080/13554794.2012.690421
21. Saraga M, Misson N, Cattani E. Ketogenic diet in bipolar disorder. Bipolar Disord. (2020) 22:765. doi: 10.1111/bdi.13013
22. Sarnyai Z, Palmer CM. Ketogenic therapy in serious mental illness: emerging evidence. Int J Neuropsychopharmacol. (2020) 23:434–9. doi: 10.1093/ijnp/pyaa036
23. Masood W, Annamaraju P, Uppaluri KR. Ketogenic Diet. In: StatPearls. Treasure Island FL: StatPearls Publishing (2022-). updated November 26, 2021. Available online at: https://www.ncbi.nlm.nih.gov/books/NBK499830/ (accessed May 10, 2022).
24. Yancy WS Jr, Olsen MK, Guyton JR, Bakst RP, Westman EC. A low-carbohydrate, ketogenic diet versus a low-fat diet to treat obesity and hyperlipidemia: a randomized, controlled trial. Ann Intern Med. (2004) 140:769–77. doi: 10.7326/0003-4819-140-10-200405180-00006
25. Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiat. (1960) 23:56–62. doi: 10.1136/jnnp.23.1.56
26. Montgomery SA, Åsberg M, A. new depression scale designed to be sensitive to change. Br J Psychiatry. (1979) 134:382–9. doi: 10.1192/bjp.134.4.382
27. Kay SR, Fiszbein A, Opler LA. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull. (1987) 13:261–76. doi: 10.1093/schbul/13.2.261
28. Leucht S, Kane JM, Kissling W, Hamann J, Etschel E, Engel RR. What does the PANSS mean? Schizophr Res. (2005) 79:231–8. doi: 10.1016/j.schres.2005.04.008
29. Guy W, ed. ECDEU Assessment Manual for Psychopharmacology, Revised. Rockville, MD: Dept of Health, Education, and Welfare (US) (1976). p. 76–338.
30. Busner J, Targum SD. The clinical global impressions scale: applying a research tool in clinical practice. Psychiatry. (2007) 4:28–37.
31. Hermes ED, Sokoloff D, Stroup TS, Rosenheck RA. Minimum clinically important difference in the Positive and Negative Syndrome Scale with data from the Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE). J Clin Psychiatry. (2012) 73:526–32. doi: 10.4088/JCP.11m07162
32. Rush AJ, South C, Jain S, Agha R, Zhang M, Shrestha S, et al. Clinically significant changes in the 17- and 6-Item Hamilton Rating Scales for Depression: a STAR*D report. Neuropsychiatr Dis Treat. (2021) 17:2333–45. doi: 10.2147/NDT.S305331
33. Falissard B, Sapin C, Loze JY, Landsberg W, Hansen K. Defining the minimal clinically important difference (MCID) of the Heinrichs-carpenter quality of life scale (QLS). Int J Methods Psychiatr Res. (2016) 25:101–11. doi: 10.1002/mpr.1483
34. Donnelly JE, Blair SN, Jakicic JM, Manore MM, Rankin JW, Smith BK, et al. Appropriate physical activity intervention strategies for weight loss and prevention of weight regain for adults. Med Sci Sports Exerc. (2009) 41:459–71. doi: 10.1249/MSS.0b013e3181949333
35. Bostock ECS, Kirkby KC, Taylor BV, Hawrelak JA. Consumer reports of “keto flu” associated with the ketogenic diet. Front Nutr. (2020) 7:20. doi: 10.3389/fnut.2020.00020
37. O’Neill BJ. Effect of low-carbohydrate diets on cardiometabolic risk, insulin resistance, and metabolic syndrome. Curr Opin Endocrinol Diabetes Obes. (2020) 27:301–7. doi: 10.1097/MED.0000000000000569
38. Adams RN, Athinarayanan SJ, McKenzie AL, Hallberg SJ, McCarter JP, Phinney SD, et al. Depressive symptoms improve over 2 years of type 2 diabetes treatment via a digital continuous remote care intervention focused on carbohydrate restriction. J Behav Med. (2022). doi: 10.1007/s10865-021-00272-4
39. Pacheco A, Easterling WS, Pryer MW. A pilot study of the ketogenic diet in schizophrenia. Am J Psychiatry. (1965) 121:1110–1. doi: 10.1176/ajp.121.11.1110
40. Kraft BD, Westman EC. Schizophrenia, gluten, and low-carbohydrate, ketogenic diets: a case report and review of the literature. Nutr Metab. (2009) 6:10. doi: 10.1186/1743-7075-6-10
41. Kraeuter AK, Phillips R, Sarnyai Z. Ketogenic therapy in neurodegenerative and psychiatric disorders: from mice to men. Prog Neuropsychopharmacol Biol Psychiatry. (2020) 101:109913. doi: 10.1016/j.pnpbp.2020.109913
42. Bostock EC, Kirkby KC, Taylor BV. The current status of the ketogenic diet in psychiatry. Front Psychiatry. (2017) 8:43. doi: 10.3389/fpsyt.2017.00043
43. Morris G, Puri BK, Carvalho A, Maes M, Berk M, Ruusunen A, et al. Induced ketosis as a treatment for neuroprogressive disorders: food for thought? Int J Neuropsychopharmacol. (2020) 23:366–84. doi: 10.1093/ijnp/pyaa008
44. Sarnyai Z, Kraeuter AK, Palmer CM. Ketogenic diet for schizophrenia: clinical implication. Curr Opin Psychiatry. (2019) 32:394–401. doi: 10.1097/YCO.0000000000000535
45. Enache D, Pariante CM, Mondelli V. Markers of central inflammation in major depressive disorder: a systematic review and meta-analysis of studies examining cerebrospinal fluid, positron emission tomography and post-mortem brain tissue. Brain Behav Immun. (2019) 81:24–40. doi: 10.1016/j.bbi.2019.06.015
46. Beurel E, Toups M, Nemeroff CB. The bidirectional relationship of depression and inflammation: double trouble. Neuron. (2020) 107:234–56. doi: 10.1016/j.neuron.2020.06.002
47. Koh S, Dupuis N, Auvin S. Ketogenic diet and neuroinflammation. Epilepsy Res. (2020) 167:106454. doi: 10.1016/j.eplepsyres.2020.106454
48. Youm YH, Nguyen KY, Grant RW, Goldberg EL, Bodogai M, Kim D, et al. The ketone metabolite β-hydroxybutyrate blocks NLRP3 inflammasome-mediated inflammatory disease. Nat Med. (2015) 21:263–9. doi: 10.1038/nm.3804
49. Forsythe CE, Phinney SD, Fernandez ML, Quann EE, Wood RJ, Bibus DM, et al. Comparison of low fat and low carbohydrate diets on circulating fatty acid composition and markers of inflammation. Lipids. (2008) 43:65–77. doi: 10.1007/s11745-007-3132-7
50. Morris G, Maes M, Berk M, Carvalho AF, Puri BK. Nutritional ketosis as an intervention to relieve astrogliosis: possible therapeutic applications in the treatment of neurodegenerative and neuroprogressive disorders. Eur Psychiatry. (2020) 63:e8. doi: 10.1192/j.eurpsy.2019.13
51. Ricci A, Idzikowski MA, Soares CN, Brietzke E. Exploring the mechanisms of action of the antidepressant effect of the ketogenic diet. Rev Neurosci. (2020) 31:637–48. doi: 10.1515/revneuro-2019-0073
52. Sun L, Getz M, Daboul S, Jay M, Sherman S, Rogers E, et al. Independence of diabetes and obesity in adults with serious mental illness: findings from a large urban public hospital. J Psychiatr Res. (2018) 99:159–66. doi: 10.1016/j.jpsychires.2018.01.005
53. Calkin CV. Insulin resistance takes center stage: a new paradigm in the progression of bipolar disorder. Ann Med. (2019) 51:281–93. doi: 10.1080/07853890.2019.1659511
54. Napolitano A, Longo D, Lucignani M, Pasquini L, Rossi-Espagnet MC, Lucignani G, et al. The ketogenic diet increases in vivo glutathione levels in patients with epilepsy. Metabolites. (2020) 10:504. doi: 10.3390/metabo10120504
55. Campbell I, Campbell H. Mechanisms of insulin resistance, mitochondrial dysfunction and the action of the ketogenic diet in bipolar disorder. Focus on the PI3K/AKT/HIF1-a pathway. Med Hypotheses. (2020) 145:110299. doi: 10.1016/j.mehy.2020.110299
56. Calkin C, McClelland C, Cairns K, Kamintsky L, Friedman A. Insulin resistance and blood-brain barrier dysfunction underlie neuroprogression in bipolar disorder. Front Psychiatry. (2021) 12:636174. doi: 10.3389/fpsyt.2021.636174
57. Greene C, Hanley N, Campbell M. Blood-brain barrier associated tight junction disruption is a hallmark feature of major psychiatric disorders. Transl Psychiatry. (2020) 10:373. doi: 10.1038/s41398-020-01054-3
58. Kucukgoncu S, Kosir U, Zhou E, Sullivan E, Srihari VH, Tek C. Glucose metabolism dysregulation at the onset of mental illness is not limited to first episode psychosis: a systematic review and meta-analysis. Early Interv Psychiatry. (2019) 13:1021–31. doi: 10.1111/eip.12749
59. Lopes R, Pereira BD. Delirium and psychotic symptoms associated with hyperglycemia in a patient with poorly controlled type 2 diabetes mellitus. Innov Clin Neurosci. (2018) 15:30–3.
60. Mujica-Parodi LR, Amgalan A, Sultan SF, Antal B, Sun X, Skiena S, et al. Diet modulates brain network stability, a biomarker for brain aging, in young adults. Proc Natl Acad Sci USA. (2020) 117:6170–7. doi: 10.1073/pnas.1913042117
61. Marosi K, Kim SW, Moehl K, Scheibye-Knudsen M, Cheng A, Cutler R, et al. 3-Hydroxybutyrate regulates energy metabolism and induces BDNF expression in cerebral cortical neurons. J Neurochem. (2016) 139:769–81. doi: 10.1111/jnc.13868
62. Speyer H, Jakobsen AS, Westergaard C, Nørgaard HCB, Jørgensen KB, Pisinger C, et al. Lifestyle interventions for weight management in people with serious mental illness: a systematic review with meta-analysis, trial sequential analysis, and meta-regression analysis exploring the mediators and moderators of treatment effects. Psychother Psychosom. (2019) 88:350–62. doi: 10.1159/000502293
63. de Boer N, Guloksuz S, van Baal C, Willebrands L, Deenik J, Vinkers CH, et al. Study protocol of a randomized, double-blind, placebo-controlled, multi-center trial to treat antipsychotic-induced weight gain: the Metformin-Lifestyle in antipsychotic users (MELIA) trial. BMC Psychiatry. (2021) 21:4. doi: 10.1186/s12888-020-02992-4
64. Mangge H, Bengesser S, Dalkner N, Birner A, Fellendorf F, Platzer M, et al. Weight gain during treatment of bipolar disorder (BD)—facts and therapeutic options. Front Nutr. (2019) 6:76. doi: 10.3389/fnut.2019.00076
65. Gill H, Kang S, Lee Y, Rosenblat JD, Brietzke E, Zuckerman H, et al. The long-term effect of bariatric surgery on depression and anxiety. J Affect Disord. (2019) 246:886–94. doi: 10.1016/j.jad.2018.12.113
66. Kossoff EH, Dorward JL. The modified Atkins diet. Epilepsia. (2008) 49(Suppl. 8):37–41. doi: 10.1111/j.1528-1167.2008.01831.x
67. Kossoff EH, Zupec-Kania BA, Auvin S, Ballaban-Gil KR, Christina Bergqvist AG, Blackford R, et al. Optimal clinical management of children receiving dietary therapies for epilepsy: updated recommendations of the International Ketogenic Diet Study Group. Epilepsia Open. (2018) 3:175–92. doi: 10.1002/epi4.12225
68. Westman EC, Tondt J, Maguire E, Yancy WS Jr. Implementing a low-carbohydrate, ketogenic diet to manage type 2 diabetes mellitus. Expert Rev Endocrinol Metab. (2018) 13:263–72. doi: 10.1080/17446651.2018.1523713
69. Cucuzzella M, Riley K, Isaacs D. Adapting medication for type 2 diabetes to a low carbohydrate diet. Front Nutr. (2021) 8:688540. doi: 10.3389/fnut.2021.688540
70. Heo G, Kim SH, Chang MJ. Effect of ketogenic diet and other dietary therapies on anti-epileptic drug concentrations in patients with epilepsy. J Clin Pharm Ther. (2017) 42:758–64. doi: 10.1111/jcpt.12578