 Большое депрессивное расстройство (БДР) — крупнейший фактор потери, одно из самых распространенных и вызывающих опасения психических заболеваний, которое может не поддаваться лечению, становясь терапевтически резистентной депрессией (ТРД). В настоящей статье нами была рассмотрена возможность применения неинвазивной нейромодуляции для лечения ТРД, а также роль искусственного интеллекта в нем.
Большое депрессивное расстройство (БДР) — крупнейший фактор потери, одно из самых распространенных и вызывающих опасения психических заболеваний, которое может не поддаваться лечению, становясь терапевтически резистентной депрессией (ТРД). В настоящей статье нами была рассмотрена возможность применения неинвазивной нейромодуляции для лечения ТРД, а также роль искусственного интеллекта в нем.
Ни для кого не секрет, что депрессия ухудшает качество жизни человека. Помимо того, что она коморбидна многим патологическим состояниям, она может не поддаваться традиционным (медикаментозным) методам лечения. Депрессию, которая не реагирует на два адекватных курса антидепрессантов разных групп, называют терапевтически резистентной, или рефрактерной [1]. Но не отчаивайтесь — современная медицина активно ищет способы побороть ее.
В прошлой статье о рефрактерной депрессии [2] мы говорили о ее лечении с помощью антагонистов NMDA-рецепторов. В этой — расскажем о неинвазивной нейромодуляции!
Чуть-чуть депрессивной теории
Чтобы пойти дальше, давайте на секунду остановимся на мысли, что есть депрессия. Ангедония, тревога и апатия, как и многие другие состояния, обычно ассоциируемые с ней, связаны со сложным взаимодействием нейромедиаторов в мозге. Сторонники моноаминовой и, соответственно, серотониновой гипотезы депрессии считали, что именно дисбаланс определенных нейромедиаторов (серотонин [3], дофамин [4], норадреналин и другие) вызывает депрессивные состояния.
Сейчас мы полагаем, что не все так просто [6], и дело еще и в дендритных шипиках, количество которых уменьшается при депрессии, и в уровнях глутамата, который также влияет на количество этих шипиков [7]. Таким образом, наиболее актуальны сейчас нейропластическая и глутаматная теории депрессии, о которых можно прочитать подробнее в этих статьях «Биомолекулы»: [2], [8–10].
Неинвазивная нейромодуляция: что и почему?
Мы знаем, что ток, протекающий через ткани мозга, создает электрическое (и магнитное) поле и разность потенциалов на мембранах нейронов [11]. Это дает возможность «перезагружать» нервные клетки, чем и пользуются ученые. Так, при возбуждающей стимуляции мембраны нейронов деполяризуются, что заставляет их активизироваться, а в присутствии глутамата происходит стимуляция и NMDA-рецепторов, которые, в свою очередь, влияют на нейропластичность [12]. А стимуляция нейропластичности, как мы уже поняли, помогает бороться с депрессией, в т.ч. резистентной.
Существует и тормозная стимуляция, которая, наоборот, снижает активность зон мозга, «отвечающих» за коморбидную депрессию. Это актуально, например, при болезни Паркинсона. При ней активность левой и правой частей дорсолатеральной префронтальной коры (ДЛПФК) неодинакова, что вызывает депрессию, и с чем помогает тормозная стимуляция более активных участков мозга [13], [14].
Такие воздействия на мозг и скрининг его активности и называются нейромодуляцией. Неинвазивной она является, потому что череп вам вскрывать, как бы ни хотелось, не будут. Методы лечения в данном случае — транскраниальные, то есть проводящиеся через (лат. trans) череп (лат. cranium).
Со скринингом выручают нейрокомпьютерные интерфейсы. С их помощью можно «декодировать» активность мозга [15] и персонализировать терапию согласно его активности. Это дает возможность увеличить ответ на лечение и снизить риск побочных эффектов [16]. Такой вид терапии называется closed-loop, или замкнутый.
На этом этапе оказывается полезен искусственный интеллект (ИИ) — например, он помогает анализировать данные нейровизуализации для понимания, на какие области мозга стоит повлиять.
К интерфейсам в т.ч. относятся всем известные электроэнцефалография (ЭЭГ) и магнитно-резонансная томография (МРТ). Но какие бывают методы воздействия на активность мозга? О разных вариантах читаем дальше.
Транскраниальная магнитная стимуляция (TMS)
При этом методе «перезагрузка» активности осуществляется короткими импульсами от сильного магнитного поля величиной 1–2 Тесла с помощью мультипрофильных катушек. То есть, мозг помещают в некую зону, в которой магнитное поле, создаваемое нейронами (мы помним, что в них «течет ток»), перекрывается более сильным магнитным полем. В результате такой стимуляции импульсы изменяют паттерны активности нервных клеток и внутренний поток ионов, влияя на ментальное состояние человека.
Чаще всего используют ритмическую транскраниальную терапию (rTMS) и ускоренную (aTMS). Разница в том, что ускоренная терапия была специально разработана для лечения рефрактерной депрессии и, в отличие от 4–8 недель, необходимых для ритмической терапии, aTMS завершает терапевтический цикл через 5 дней активной стимуляции (6 сессий за один день) [17], [18]. Этот метод может позволять лечить депрессию с эффективностью до 90,5% [19], однако есть данные, показывающие, что его эффективность в целом аналогична показателям при обычном ежедневном применении TMS [17], [20].
Несмотря на то, что до сих пор остается неясным, какое количество процедур в день и продолжительность интервала между сериями импульсов являются оптимальными [21], aTMS имеет большой потенциал для лечения пациентов, которым нужен быстрый антидепрессивный эффект: например, для людей с суицидальными мыслями и намерениями [22] или тех, кто проходит лечение далеко от дома.
Еще одним видом терапии является прерывистая тета-стимуляция (iTBS). Она тоже считается усовершенствованным видом rTMS, но уже основанным на тета-всплесках активности, наблюдаемых в гиппокампе [24], где гамма-колебания (50 Гц) перекрываются более медленными тета-волнами (5 Гц). Прерывистая стимуляция активирует корковые нейроны и продлевает долговременную потенциацию нейронов, т.е. усиляет синаптическую передачу сигнала между двумя нейронами [24].
Это является определяющим фактором: больше нейронных связей, меньше симптомов депрессии. Более того, iTBS способствует восстановлению количества дендритных шипиков, эффективно облегчая симптомы длительной депрессии, влияя на префронтальную кору [25].
Магнитно-судорожная терапия (MST)
Пока упомянутые виды терапии используют сильное магнитное поле, магнитно-судорожная не отстает и использует ультрасильное. Это неслучайно — данный метод основан на вызове контролируемых «припадков» в мозгу, которые обычно длятся не более 10 секунд. В общем, сильно вдохновившись методологией электросудорожной терапии, MST интегрировала техники нейромодуляции еще и от ритмической магнитной стимуляции, чтобы совладать с резистентной депрессией [16].
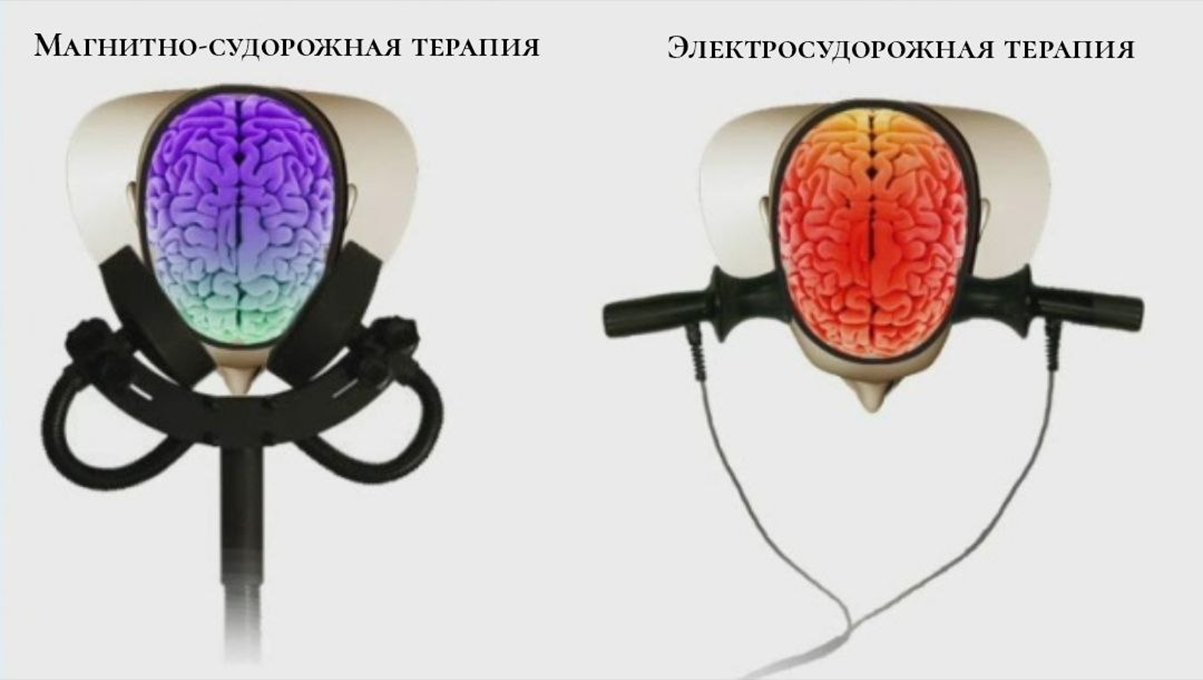
Так как МСТ воздействует менее «интенсивно», чем электросудорожная терапия (ЭСТ), у этого метода меньше побочных эффектов [26], например, в отношение памяти [27]. И, благодаря новому механизму действия, график лечения может быть более гибким, чем при ЭСТ [26].
Исследования показывают, что симптомы у пациентов с депрессией после магнитно—судорожной терапии, в целом, смягчаются. Так, показатели ответа на терапию составляют 60%, а ремиссии — 47%, с некоторым улучшением памяти [28]. Также предполагается, что потенциально более высокая эффективность лечения наблюдается у пациентов, получавших МСТ высокой частоты (100 Гц) по сравнению с пациентами, получавшими МСТ низкой частоты (25 Гц), с показателями ответа и ремиссии 41,7% и 33,5%, соответственно [29]. Но, конечно, это новая область, в которой необходимо больше исследований.
Электрическая стимуляция

Помимо лечения «магнитом», есть и такой вид стимуляции. Связь с ЭСТ в нем тоже есть, но только историческая — как и прошлые подходы, современные виды стимуляции током основываются на ней, но идут дальше. Если ЭСТ можно сравнить с полной «перезагрузкой» мозга, то эти методы действуют только локально, мягко «настраивая» отдельные участки мозга.
Различают терапию с воздействием постоянным током (tDCS) и переменным (CES). Систематический обзор клинических испытаний [30] показал, что в 71% исследований tDCS демонстрирует разные положительные эффекты как в качестве монотерапии, так и в комбинации с другими методами лечения, а возможные побочные эффекты были, в основном, легкими [30]. Сочетание tDCS с когнитивной терапией, основанной на осознанности (MBCT), обеспечивает долгосрочность улучшений [31]. И этот подход решает ключевую проблему резистентной депрессии — поддержание ремиссии. Подробнее о том, как работает tDCS, вы можете почитать в этой статье «Биомолекулы»: «Лекарство от депрессии: как электричество разгоняет тоску» [32].
Краниальная электротерапевтическая стимуляция (CES), в свою очередь, тоже является безопасным методом с небольшим, но статистически значимым общим антидепрессивным эффектом [33]. Наибольшая польза от CES наблюдается при ее использовании в качестве дополнительной терапии. Однако данные об эффективности CES именно при резистентных формах депрессии менее определенны и требуют дальнейшего изучения.
Обратите внимание на фотографии! Интересно, что, в отличие от предыдущих видов нейромодуляции, данные подходы обычно более портативны.
Использование ИИ в нейромодуляции
В данной статье мы уже немного затронули ИИ — его и машинное обучение используют во время нейровизуализации мозговой активности, а также для прогнозирования индивидуального ответа на лечение. Разберемся с этим подробнее.
Так, наиболее частые виды нейровизуализации, куда интегрируют искусственный интеллект, это функциональная МРТ (фМРТ), которая, в отличие от обычной, фокусируется только на работе мозга, и ЭЭГ [34]. Также может использоваться диффузионно—взвешенная МРТ (ДВ МРТ) [35]. Она позволяет на самом раннем этапе выявить острые инсульты, опухоли и воспаления по изменению «клеточного отёка», а также создавать трехмерные модели головного мозга [36].
Нейровизуализация дает «материал» для ИИ, чтобы вычислить «связность» между различными участками мозга, а затем с помощью агломеративной иерархической кластеризации (метода машинного обучения без учителя) определяется та зона, в которой наиболее «негативная корреляция», т.е. с большей вероятностью «отвечающая» за депрессию. Эта зона и становится мишенью для стимуляции, например, в TMS-терапии [35], [37].
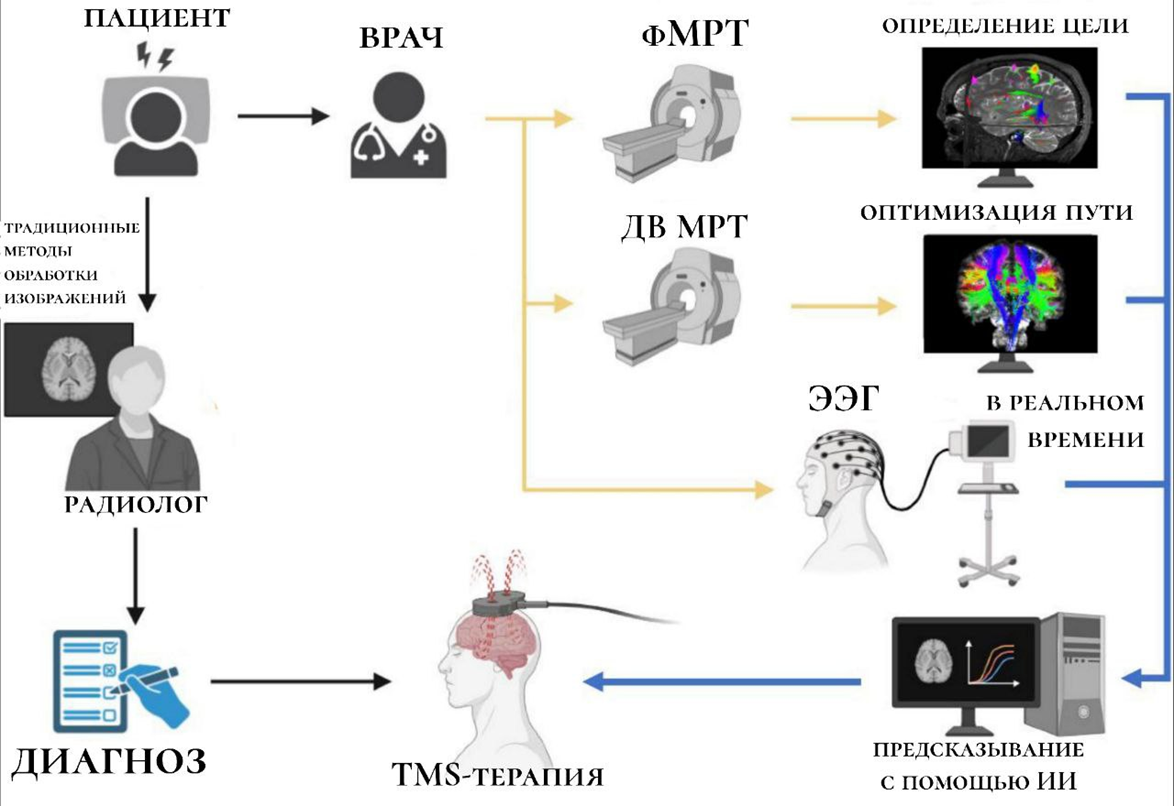
Функциональная «связность» является биомаркером резистентной депрессии. То есть, используя эти данные, можно не только регулировать импульс и частоту при магнитной терапии [38], повышая ее эффективность [39], но и в целом прогнозировать возможный ответ на лечение.
Так, машину обучают «понимать» и интерпретировать сигналы ЭЭГ [40], [41], например, с помощью свёрточной нейронной сети (метода глубокого машинного обучения). Точность прогноза ответа на TMS-терапию при этом в среднем составляет 97,1% [42], на tDCS — 71,94 % (значение зависит от диапазона ЭЭГ) [43]. Также используют и поверхностные подходы — например, метод опорных векторов. С его помощью точность прогноза для TMS колеблется от 87 до 97% [37], [44], для tDCS-терапии составляет 91,25% [45].
Перспективы
Нейромодуляция — это инновационное усовершенствование по сравнению с традиционными методами лечения рефрактерной депрессии и депрессивных расстройств в целом, а машинное обучение и ИИ позволяют повысить эффективность такого лечения и становятся ее неотъемлемой частью. Возможно, именно вы сможете продолжить исследования в этой области!
Литература
- Souery D., Papakostas G., Trivedi M. (2006). Treatment-resistant depression. Journal of Clinical Psychiatry. 67, 16–22;
- Лечение рефрактерной депрессии: с чем ее «едят» и при чем здесь кетамин?;
- Серотониновые сети;
- Дофаминовые болезни;
- Тайны голубого пятна;
- N+1: «Серотонин перестали винить в развитии депрессии»;
- David E Olson. (2018). Psychoplastogens: A Promising Class of Plasticity-Promoting Neurotherapeutics. J Exp Neurosci. 12, 117906951880050;
- Краткая история антидепрессантов;
- Чем заедать тоску? Механизмы антидепрессивного действия средиземноморской и кетогенной диет;
- Фармакофоры нейропластичности;
- Формирование мембранного потенциала покоя;
- Как происходит выделение нейромедиатора;
- Weifang Yin, Anming Li, Baiyuan Yang, Chao Gao, Yanfei Hu, et. al.. (2022). Abnormal cortical atrophy and functional connectivity are associated with depression in Parkinson’s disease. Front. Aging Neurosci.. 14;
- Sheng Zhuang, Fu-Yu Wang, Xin Gu, Jia-Jing Wu, Cheng-Jie Mao, et. al.. (2020). Low-Frequency Repetitive Transcranial Magnetic Stimulation over Right Dorsolateral Prefrontal Cortex in Parkinson’s Disease. Parkinson’s Disease. 2020, 1-7;
- Lucine L. Oganesian, Maryam M. Shanechi. (2024). Brain–computer interfaces for neuropsychiatric disorders. Nat Rev Bioeng. 2, 653-670;
- Yijiang Li. (2023). Brain-Computer Interface Based Neuromodulation on Treatment of Depression. HSET. 74, 231-239;
- A. Irem Sonmez, Deniz Doruk Camsari, Aiswarya L. Nandakumar, Jennifer L. Vande Voort, Simon Kung, et. al.. (2019). Accelerated TMS for Depression: A systematic review and meta-analysis. Psychiatry Research. 273, 770-781;
- Jean-Philippe Miron, Helena Voetterl, Linsay Fox, Molly Hyde, Farrokh Mansouri, et. al.. (2021). Optimized repetitive transcranial magnetic stimulation techniques for the treatment of major depression: A proof of concept study. Psychiatry Research. 298, 113790;
- Kevin A. Caulfield, Holly H. Fleischmann, Mark S. George, Lisa M. McTeague. (2022). A transdiagnostic review of safety, efficacy, and parameter space in accelerated transcranial magnetic stimulation. Journal of Psychiatric Research. 152, 384-396;
- Paul B. Fitzgerald, Kate E. Hoy, David Elliot, R. N. Susan McQueen, Lenore E. Wambeek, Zafiris J. Daskalakis. (2018). Accelerated repetitive transcranial magnetic stimulation in the treatment of depression. Neuropsychopharmacol. 43, 1565-1572;
- Sanne J. H. van Rooij, Amanda R. Arulpragasam, William M. McDonald, Noah S. Philip. (2024). Accelerated TMS — moving quickly into the future of depression treatment. Neuropsychopharmacol.. 49, 128-137;
- Christopher E. Hines, Scott Mooney, Nora L. Watson, Stephen W. Looney, David J. Wilkie. (2022). Repetitive Transcranial Magnetic Stimulation Promotes Rapid Psychiatric Stabilization in Acutely Suicidal Military Service Members. J ECT. 38, 103-109;
- Oscar Arias-Carrión. (2008). Basic mechanisms of rTMS: Implications in Parkinson’s disease. Int Arch Med. 1, 2;
- Jeffrey D. Voigt, Andrew F. Leuchter, Linda L. Carpenter. (2021). Theta burst stimulation for the acute treatment of major depressive disorder: A systematic review and meta-analysis. Transl Psychiatry. 11;
- Ahmad Shamabadi, Alireza Hasanzadeh, Shahin Akhondzadeh. (2021). Integrating Psychiatry and Medical Biotechnology as a Way to Achieve Scientific, Precision, and Personalized Psychiatry. AJMB;
- Cory Weissman, Daniel Blumberger, Zafiris Daskalakis. (2022). MST for treatment-resistant depression. Managing Treatment-Resistant Depression. 309-317;
- Julia D. Polster, Sarah Kayser, Bettina H. Bewernick, René Hurlemann, Thomas E. Schlaepfer. (2015). Effects of Electroconvulsive Therapy and Magnetic Seizure Therapy on Acute Memory Retrieval. The Journal of ECT. 31, 13-19;
- Jian Wang, Fidel Vila-Rodriguez, Wei Jiang, Yian-Ping Ren, Chang-Ming Wang, Xin Ma. (2019). Accelerated Magnetic Seizure Therapy for Treatment of Major Depressive Disorder. J ECT. 35, 135-138;
- Zafiris J. Daskalakis, Julia Dimitrova, Shawn M. McClintock, Yinming Sun, Daphne Voineskos, et. al.. (2020). Magnetic seizure therapy (MST) for major depressive disorder. Neuropsychopharmacol.. 45, 276-282;
- John Li, Simon Kung, Paul Croarkin, Maria Lapid. (2024). Transcranial Direct Current Stimulation (tDCS) for Treatment Resistant Depression (TRD): A Systematic Review. The American Journal of Geriatric Psychiatry. 32, S99;
- Aurore Monnart, Marie-Anne Vanderhasselt, Elisa Schroder, Salvatore Campanella, Philippe Fontaine, Charles Kornreich. (2019). Treatment of Resistant Depression: A Pilot Study Assessing the Efficacy of a tDCS-Mindfulness Program Compared With a tDCS-Relaxation Program. Front. Psychiatry. 10;
- Лекарство от депрессии: как электричество разгоняет тоску;
- Shu-Yen Liu, Ruey Chen, Chia-Hui Wang, Kondwani Joseph Banda, Chien-Mei Sung, et. al.. (2025). Efficacy of cranial electrotherapy stimulation for treating primary and secondary depression in adults: A meta-analysis of randomized controlled trials. Journal of Affective Disorders. 382, 488-497;
- Matthew Squires, Xiaohui Tao, Soman Elangovan, Raj Gururajan, Xujuan Zhou, et. al.. (2023). Identifying predictive biomarkers for repetitive transcranial magnetic stimulation response in depression patients with explainability. Computer Methods and Programs in Biomedicine. 242, 107771;
- Bing Liu, Chunyun Hu, Panxiao Bao. (2025). Precision TMS through the integration of neuroimaging and machine learning: optimizing stimulation targets for personalized treatment. Front. Hum. Neurosci.. 19;
- Derek K. Jones. Diffusion MRI. Oxford University Press, 2010. — 784 p.;
- H.J. Hopman, S.M.S. Chan, W.C.W. Chu, H. Lu, C.-Y. Tse, et. al.. (2021). Personalized prediction of transcranial magnetic stimulation clinical response in patients with treatment-refractory depression using neuroimaging biomarkers and machine learning. Journal of Affective Disorders. 290, 261-271;
- Abigail Tubbs, Enrique Alvarez Vazquez. (2024). Engineering and Technological Advancements in Repetitive Transcranial Magnetic Stimulation (rTMS): A Five-Year Review. Brain Sciences. 14, 1092;
- Pravat K. Mandal, Komal Jindal, Saurav Roy, Yashika Arora, Shallu Sharma, et. al.. (2023). SWADESH: a multimodal multi-disease brain imaging and neuropsychological database and data analytics platform. Front. Neurol.. 14;
- Zhong-Peng Dai, Qiang Wen, Ping Wu, Yan-Ni Zhang, Cai-Lian Fang, et. al.. (2025). γ neuromodulations: unraveling biomarkers for neurological and psychiatric disorders. Military Med Res. 12;
- Aoyang Liu, Haodong Jing, Yulong Liu, Yongqiang Ma, Nanning Zheng. (2024). Hidden States in LLMs Improve EEG Representation Learning and Visual Decoding. Frontiers in Artificial Intelligence and Applications;
- Mohsen Sadat Shahabi, Ahmad Shalbaf, Reza Rostami, Reza Kazemi. (2023). A convolutional recurrent neural network with attention for response prediction to repetitive transcranial magnetic stimulation in major depressive disorder. Sci Rep. 13;
- Wenyi Xiao, Jijomon C. Moncy, Rachel D. Woodham, Sudhakar Selvaraj, Nahed Lajmi, et. al.. (2025). Home-based transcranial direct current stimulation (tDCS) in major depressive disorder: Enhanced network synchronization with active relative to sham and deep learning-based predictors of remission. Personalized Medicine in Psychiatry. 49-50, 100147;
- NW Bailey, KE Hoy, NC Rogasch, RH Thomson, S McQueen, et. al.. (2019). Differentiating responders and non-responders to rTMS treatment for depression after one week using resting EEG connectivity measures. Journal of Affective Disorders. 242, 68-79;
- Alejandro Albizu, Aprinda Indahlastari, Paulo Suen, Ziqian Huang, Jori L. Waner, et. al.. (2024). Machine learning-optimized non-invasive brain stimulation and treatment response classification for major depression. Bioelectron Med. 10.
